


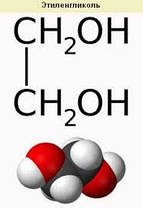
Етилгліколь технічний
У компанії підключені електронні платежі. Тепер ви можете купити будь-який товар не покидаючи сайту.ТІЛЕНГЛІКОЛЬ (1,2-этандиол) НОСН2СН2ОН, мол. м. 62,07; безцв. в'язка гіроскопич. рідина без запаху, солодкого смаку; тобто пл.-12,7 °С, тобто кип. 197,6 °С, 100°С/16 мм рт. ст.; 1,1088;1,4316; 19,83 мПа х с (20 °С); 48,4 мН/м (20 °С); 7,3 х 10-30 Кл-м (30 °С); х ур-ні температураної залежності тиску пара в інтервалі 25-90 °С: lgp (м рт. ст.) = 8,863 - 2694,7/t; 11,64 Дж/моль; 58,71 Дж/моль; рідини - 1180,3 Дж/моль (20 °С); газу -397,75 кДж/моль; теплопровідність 0,29 Вт/(м х град), електропровідність 1,07 х 10-6 см см 1, 38,66 (20 °С). У воді, спиртах, кетонах та друзях, помірно - в бензолі, толуолі, дієтіловому ефірі, ССl4. У етиленглико погано розцвітає. і тварини олії і не розливів. мінер. масла, парафіни, каучук, ацетил- і етил-целюлоза, полівінілхлорид. Коли етилгліколь розчинюється у воді, виділяється теплота і зменшується об’єм.
Водні р-ри замерзають при низьких т-рах: Концентрація етилгліколя, % за об'ємом 20 30 40 50 66,7 80 т-ра замерзання, °С -8 -24 -36 -75 -29.
Етилгліколь має всі свої гліколі. З лужними металами і щілинами утворює глікотати, з орг. к-ти або їх ангідридами - одно- і двозамісні складні ефіри, з HHal - етангалогенгидрини НОС2СН2На1, з РС15 - дихлортан С1СН2СН2С1, з акрилонітрілом - моно- і ди(2-цитолинові) ефіри етиленгліля, сов. HOCH2CH2OCH2CN і [CH2CH2CN]2, при дегідації - це ацетальдегід (у присутнє. ZnCl2, диетиленгліколь (у присутнях. NOH) або діоксан (при нагрі. в присутньому стані. H2SO4, з етиокідом - поліетиленгликолі Н(СН2СН2nОН. При окисленні етилгліколю, залежно від умов і окислювача утворюється суміш гліколевої альдегида НОСН2СНО, гліколової к-ти НОСН2СООН, гліоксаля ОНСНО, гліоксальової к-ти ОНСООН і щаве к-ти; окислення мол. кисень призводить до пероксидів, формальдегиду, мурашки к-те. КМnО4 і К2Cr27 окиснюють етиленгліколь до CO2 і Н2О, і етилгліколь отримують гідрацію етилоксиду. Процес виконується при 130-150 °С і тиск 1,5-2 МП при співвідношенні етиленксид : вода (1:8)-(1:15). У якості побічних продуктів утворюються ди-, три і полігліколі. Останні результати збільшуються при збільшенні етиленксиду. У присутнь. к-ти і щілини швидкість р-ції зростає, але виникає проблема коррозії обладнання і очищення елінголя. Як правило, етилгліколь поєднується з етиленксидою; при цьому використовують очищений товарний етиок або 9-12% р-р, що знижує самостійність елінгіколя, але погіршує його якість. Випускають етилгліколь двох марок: волоконний і антифризний; для першого ставить дуже жорсткі вимоги до домішок альдегідів (поглинання УФ області при 275 нм повинно складатися принаймні 95-97%). Перша проминала етиленгликоля базувалася на гідролізі діхлоретана водним р-ром соди при 200 °С і тиск 10 МП: С1СН2С1 + Na2CO3 + Н2ОНОСН2СН2СН2ОН + 2NaCl + CO2. Етиленгліколь може бути отримано взаємодопоможно. Етилексиди з CO2 при тому-рі 80-120 °С і тиск 2-5 МПа в присут. галогенидів лужних металів, аммонія або амінів з наступним. гідратація етиленбонату: Цей метод дозволяє використовувати водний р-р етиленксіда (1:1, вихід 97-98%. Гільнгліколь утворюється також під час ацетоксилування етилену з потом, гідролізом моно- і діацетатів етльгліколя (кат.- хлориди Pd, Li, нітрати Fe, Ni), брак методу - висока корозіонність середовища, проблема відокремлення солей та продуктів р-ції, необхідність регенерації каталізатора. При зменшенні видобутку нафти та різкому збільшенні вартості етилену є цікавим методом синтезу етилгліколя з альтернативного джерела: синтез-газа, метанола, CO та води при т-рі 200 °С і тиску 70 МПа або в рідкому фазі при 40 МПа в присутнє. Оксигінних мідно-магнієвих або пологових каталізаторів; з CO і Н2 - через диефіри щавильової к-ти. Етилгліколь використовують в хім., текстильної, автомобільної, авіаційної, електротехн. пром-сті; 41-45% світового етиленгликолю використовується для отримання синтетич. поліефірних волокон і плівок, ~ 40% - в вимови-ві антифризів. Етилгліколь також застосовують у виробництві гідравліч і загартованих рідин, поліуретанів, акідних смол і д. Етилгліколь токсичний при потраплянні всередину, діє на центр. нервову систему і нирки; смертельна доза 1,4 г/кг. ПДК в повітрі робочої зони 5 мг/м3. Етилгліколь- горюча рідина. У відкритому тиглі 120 градусів, тобто самовідлив. 380 °С, КПВ у повітрі: нижній 3,8, верхній 6,4% (за об’ ємом).
Темні межі спалаху: нижній 112 °С, верхній 124 °С.
Світове споживання етилгліколю ~ 8 мільйонів, так як на рік (1992 рік).
Фасовка від 5л. Надсилання по Україні!
Прикрасие! Якість! Товар от производителя!
| Основні | |
|---|---|
| Країна виробник | Польща |
- Ціна: від 70 ₴/кг

